在电解质存在下,利用水溶性聚合物如聚乙二醇(PEG)、吐温(Tw een)-80的水溶液的分相行为萃取分离金属离子的体系,小分子有机物如乙醇、丙醇在硫酸铵、氯化钠等电解质存在下,可基于相似相溶原理萃取某些金属离子的电中性离子缔合物或螯合物。这边分析研究了氯化钠存在下丙醇-碘化钾体系在盐酸介质中的分相条件及对铂(II)、钯(II)的萃取行为,发现体系也可以以不同的机理,即离子对形成机理定量萃取铂(II)、钯(II)碘络阴离子,而贱金属几乎不萃取。将这一技术应用于合成样及实际样品中铂(II)、钯(II)的分离,效果满意,与传统萃取方法相比,本方法不使用有毒的有机溶剂、无需进行反萃取。而与高分子聚合物-盐-水体系相比,本方法具有分相清晰、萃取相不含聚合物、对测定干扰小等优点,尤其适合于多元素的分光光度法、电化学法或ICP-A ES法等测定前从贱金属基体中分离铂、钯。
这种方法可用于从贱金属中分离铂、钯。对阳极泥、砂铂矿、废催化剂样品中的铂、钯进行了分离,分析结果与其它方法相符,并对萃取机理也进行了探讨。
一、实验部分
1、仪器与试剂
721型分光光度计(日立E28000型原子吸收分光光度计)。碘化钾溶液:1摩尔/升;铂标准溶液:100微克/毫升,钯标准溶液:100微克/毫升,均为0.6摩尔/升盐酸介质;所用试剂均为分析纯。
2、实验方法
取0.5毫升标准溶液,于红外灯下蒸至近干,加入一定量的盐酸及碘化钾溶液,加5毫升水,同时加入一定量的丙醇和氯化钠,并使其最后体积为20毫升,振荡萃取2分钟,分出有机相及水相,分别制成10%(V/V)盐酸溶液,测定水相和有机相中待测离子的含量,计算萃取率。钯的测定用原子吸收法,铂的测定用DbDO光度法。
二、结果与讨论
1、分相条件
研究了硫酸铵、氯化钠及盐酸浓度对分相的影响。硫酸铵和氯化钠均能使体系分相,随着盐酸浓度增加,分相所需的盐浓度增加,这可能是因为高酸度下丙醇质子化作用的增加,导致丙醇有较高极性,水溶性增加,从而不易形成不溶于水的丙醇相。如使用氯化钠,当盐酸浓度大于1.8摩尔/升时,增加氯化钠浓度也很难形成丙醇相,而使用硫酸铵,盐酸浓度大于2.4摩尔/升时,相平衡才被破坏,这反映出硫酸铵比氯化钠有更强的盐析能力,但考虑到氯化钠有利于贵金属的分离,本文选择氯化钠,最佳分相条件为:25%(V/V)丙醇,2.5克/10毫升氯化钠,相图见图1。
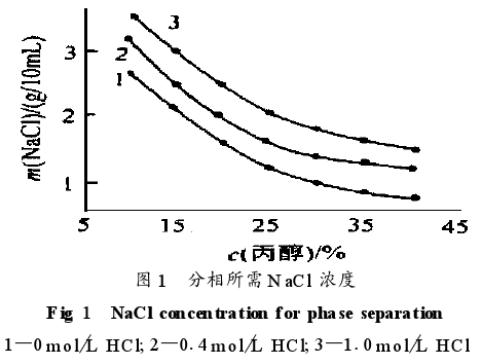
2、萃取条件的选择
对影响萃取的因素,如振荡时间,盐酸浓度,碘化钾浓度进行实验,结果表明:萃取1分钟即达平衡,盐酸浓度增加萃取率增加,当盐酸浓度达0.24摩尔/升时,萃取率已达最大,考虑到酸度过高不利于相平衡,这边选择的盐酸浓度为0.6摩尔/升;碘化钾浓度增加,萃取率增加,但当碘化钾浓度大于0.12摩尔/升时萃取率反而下降,这可能是高浓度的碘化钾与贵金属碘络阴离子产生竞争反应的结果,这边最终确定的萃取条件是:0.6摩尔/升盐酸,0.08摩尔/升碘化钾,振荡萃取时间为2分钟。
3、合成样及实际样品的分离
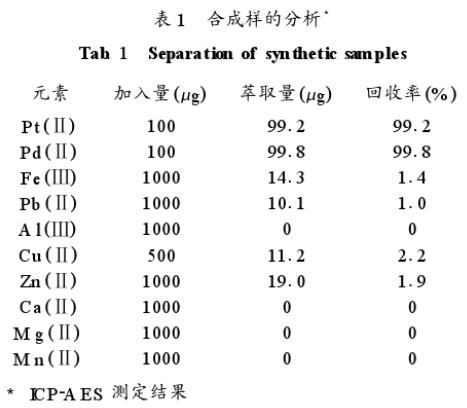
配制如表1所示合成样,用本法萃取后测定丙醇相中金属离子的含量。实验结果表明,体系能定量萃取铂、钯,对常见贱金属的萃取率则很低,可用于铂、钯与大量贱金属的分离。分别称取一定量的砂铂矿、铜阳极泥、废催化剂样品,用新配制王水加热溶解2小时,以盐酸驱赶硝酸,酸不溶物用过氧化钠熔融分解,以水浸取,酸化并与酸溶液合并,制成含0.6摩尔/升盐酸的试液,按实验方法分离及测定(见表2)。
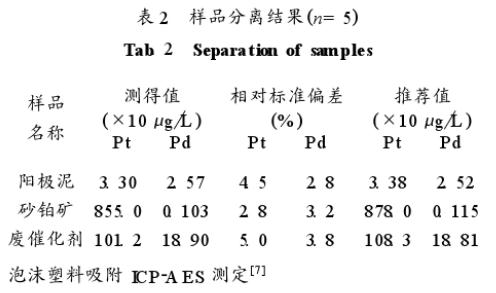
4、萃取机理的探讨
分别将铂(II)、钯及常见贱金属锰(II)、锌(II)、铁(III)、铅(II)、铝(III)、钙(II)、铜(II)按照萃取条件处理后使其分别通过阳离子树脂交换柱及阴离子树脂交换柱,结果表明:阴离子交换柱对铂、钯的吸附率大于99.0%,对贱金属离子的吸附率均小于1.5% ;阳离子交换柱对铂、钯吸附率小于0.8%,对贱金属的吸附率均大于97.6%,这表明在实验条件下,铂(II)、钯(II)以碘络阴离子形态存在,而贱金属仍然是阳离子,这与金属离子的碘络合物的稳定性有关。而增加酸度有利于萃取及萃取有较快的动力学速率表明体系对铂(II)、钯(II)碘络阴离子的萃取具有电价作用特征,即在盐酸介质中,丙醇质子化带正电荷,通过离子对形成机理萃取带负电荷的铂(II)、钯(II)碘络阴离子。
 钯碳回收
钯碳回收
